Biología
Fisiología aplicada a la producción de la caña de azúcar en Colombia
Quevedo Amaya Y. M.; Cepeda Quevedo A. M.; López Murcia M. Á. | NOV 2023 | ISBN 978-958-8449-28-9
Introducción
La Fisiología Vegetal es la ciencia que estudia el funcionamiento de las plantas. En tal sentido explica, mediante leyes químicas y físicas, cómo las plantas usan la radiación solar para sintetizar, a partir de sustancias inorgánicas, moléculas orgánicas con las que construyen las complejas estructuras que forman su cuerpo. No obstante, el principal objeto de la Fisiología Vegetal es tratar de comprender cómo se integran los procesos químicos y físicos que ocurren en diferentes lugares y estados del desarrollo de las plantas y cómo son modulados (Azcón Bieto y Talón, 2013). Juega, así, esta ciencia un papel fundamental en el desarrollo de los sistemas productivos agrícolas con base en el correcto entendimiento de los procesos que ocurren en la planta de cultivo desde el nivel celular hasta el nivel de comunidad, en un contexto de interacción con otras plantas de la misma especie y con las variables climáticas prevalecientes del lugar
donde crece y se desarrolla. Sin embargo, el entendimiento de los procesos y fenómenos fisiológicos que suceden en la planta no es suficiente per se, sino que debe ser la base para construir un conocimiento aplicado que se traduzca en nuevas o mejores prácticas de manejo del cultivo de la caña de azúcar y en la producción de materiales genéticos mejorados.
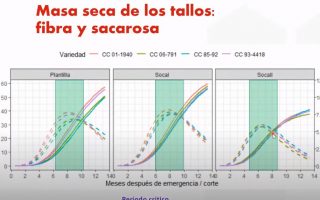
La fisiología de la producción se encarga del estudio de los factores y componentes que determinan el rendimiento real de un sistema productivo y a la vez ayuda a detectar brechas, que deben cerrarse, con respecto al rendimiento potencial. Frecuentemente la fisiología de la producción involucra el estudio de los llamados componentes del rendimiento, es decir, las variables fisiológicas que condicionan la producción de un cultivo por unidad de área por unidad de tiempo. En la caña de azúcar se han identificado los tres principales componentes del rendimiento: el número de tallos molederos por hectárea, el peso individual del tallo y la concentración de sacarosa por unidad de masa del tallo.
A manera de nota aclaratoria, dada la tendencia que existe en la agroindustria azucarera colombiana a considerar como rendimiento únicamente la relación entre el peso de la caña de azúcar procesada y el peso de los quintales de azúcar obtenidos, es necesario recabar que este capítulo aborda los diferentes factores que inciden en la productividad del cultivo, que para la mayoría de especies son denominados ‘componentes del rendimiento’. En este propósito, desarrolla los conceptos teóricos y las implicaciones de la formación del número de tallos, el peso del tallo y la concentración de sacarosa por unidad de peso del tallo, con base en la información obtenida de experimentos con variedades mejoradas por Cenicaña (CC), en las condiciones del valle del río Cauca.
Acerca de los autores
Quevedo Amaya, Y. M.
Ingeniero agrónomo con maestría en ciencias agrarias – fisiología de cultivos. Egresado en el 2013 de la Universidad del Tolima, y en el 2020 de la Universidad Nacional de Colombia – sede Bogotá. En el año 2012 realizó su trabajo de grado en fisiología de semillas de algodón en el Centro de Investigación Nataima de Agrosavia. Entre los años 2013 – 2020 trabajó como profesional de apoyo a la investigación en el Centro de Investigación Nataima de Agrosavia donde su foco de trabajo fue la investigación en mejoramiento genético y fisiología de cultivos semestrales como maíz, algodón, arroz y perennes como cacao. Siendo primer autor y coautor de diversos trabajos publicados en revistas indexadas. Entre los años 2017 al 2019 llevó a cabo su tesis de maestría que tuvo como objetivo dilucidar los efectos y respuestas morfológicas, fisiológicas y bioquímicas del algodón al estrés por déficit hídrico. En el año 2020 se vinculó al programa de agronomía del Centro de Investigación de la caña de azúcar de Colombia (Cenicaña) como fisiólogo. Allí es investigador principal y asociado de proyectos de investigación que apuntan al conocimiento del funcionamiento fisiológico del cultivo de caña, con el objetivo de formular y evaluar prácticas de manejo que conduzcan a mejorar la productividad, rentabilidad o generar nuevos materiales genéticos. Actualmente es el coordinador del área de investigación en Fisiología vegetal y Maduración del programa de agronomía de Cenicaña.
Cepeda Quevedo, A. M.
Ingeniera Agrónoma y candidata a la maestría en Ciencias Agrarias – Fisiología de cultivos, egresada en el 2017 de la Universidad Nacional de Colombia – sede Palmira. Realizó su pasantía profesional en Cenicaña y se vinculó al programa de agronomía como profesional en el año 2019, integrándose al área de fisiología vegetal. En la actualidad, desarrolla y colabora en investigación agrícola, específicamente en el estudio del estrés abiótico y la ecofisiología, con el objetivo de desarrollar prácticas agronómicas efectivas y sostenibles frente a la variabilidad climática en el cultivo de la caña de azúcar.
López Murcia, M. Á.
Ingeniero agrónomo con maestría en ciencias agrarias – fisiología de cultivos y doctorado en agronomía con énfasis en Fisiología y mejoramiento de cultivos. Egresado en el 2006 de la Universidad Nacional de Colombia – sede Bogotá. Allí llevó a cabo su trabajo de grado en bioestimulación microbiana en el cultivo de arveja. Posteriormente ingresó a la maestría en fisiología de cultivos donde se enfocó en el modelamiento matemático del crecimiento de cultivos ornamentales, y para el año 2019 obtuvo el título de doctor por la universidad de Purdue en Indiana – Estados Unidos. Durante su doctorado se enfocó en la identificación de marcadores moleculares asociados a parámetros fisiológicos relacionados con la fotosíntesis del cultivo de soja. Ha sido profesor de fertilización, fisiología vegetal y de cultivos de la Universidad Nacional de Colombia sede Bogotá y de la Universidad de Ciencias Ambientales y Aplicadas (UDCA). Estuvo vinculado al centro de investigación de la caña de azúcar de Colombia (Cenicaña) entre el 2012 y 2016 donde se desempeñó como Fisiólogo, enfocado en la investigación de la formación de componentes de la productividad del cultivo de caña y su relación con la fotosíntesis. Posteriormente, ocupó el cargo de director del programa de agronomía de Cenicaña, donde lideró el equipo de agronomía para contribuir a través de la investigación participativa, básica y aplicada, en el incremento de la productividad, rentabilidad y sostenibilidad de la agroindustria de la caña.
Alvarado-Sanabria O. H., Garcés-Varón G. A. y Restrepo- Díaz, H. (2017). The effects of night-time temperatures on physiological and biochemical traits in rice. Not. Bot. Horti Agrobot. Cluj-Napoca 45, pp. 157–163. doi:10.15835/nbha45110627.
Amaya A., Cock J., Hernández A. y Irvine J. (1995). Biología, en El Cultivo de la Caña en la Zona Azucarera de Colombia, eds. C. D. C., T. A. y I. E. C.H (Cali, Colombia: Cenicaña), pp. 31–62. Available at: https://www. cenicana.org/pdf_privado/documentos_no_ seriados/libro_el_cultivo_cana/libro_p3-394.pdf [Accessed June 11, 2021].
Anitha R., Christy P., Mary N. y Purushothaman R. S. (2016). Biometric and physiological characteristics of sugarcane ratoon under waterlogging condition. Plant Arch. 16, pp. 105–109. Available at: http://www.plantarchives.org/PDF 16 – 1/105-109 (PA3-3181).pdf [Accessed May 5, 2022].
Azcón Bieto J. y Talón M. (2013). Fundamentos de fisiología vegetal. 2a ed. Madrid: McGraw-Hill.
Bell M. J. y Garside, A. L. (2005). Shoot and stalk dynamics and the yield of sugarcane crops in tropical and subtropical Queensland, Australia. F. Crop. Res. 92, pp. 231–248. doi:10.1016/j.fcr.2005.01.032.
Bonnett G. D. (2013). Developmental Stages (Phenology). Sugarcane Physiol. Biochem. Funct. Biol., pp. 35–53. doi:10.1002/9781118771280.CH3.
Boyer J. S. (1995). Biochemical and biophysical aspects of water deficits and the predisposition to disease. Annu. Rev. Phytopathol. 33, pp. 251–274. doi:10.1146/annurev.py.33.090195.001343.37
Caruso P., Baldoni E., Mattana M., Pietro Paolo D., Genga A., Coraggio I. et al. (2012). Ectopic expression of a rice transcription factor, Mybleu, enhances tolerance of transgenic plants of Carrizo citrange to low oxygen stress. Plant Cell, Tissue Organ Cult. 109, pp. 327–339. doi:10.1007/s11240-011-0098-1.
Casierra-Posada F., Barreto V. E. y Fonseca O. L. (2004). Crecimiento de frutos y ramas de duraznero (Prunus persica L. Batsch, cv. Conservero) en los altiplanos colombianos. Agron. Colomb. 22, 40–45.
Casierra-Posada F., Hernández D. I., Lüdders P. y Ebert G. (2003). Crecimiento de frutos y ramas de manzano Anna (Malus domestica Borkh.) cultivado en los altiplanos colombianos. Agron. Colomb. 21, pp. 69–74.
Castro M. (2008). Cana: seca reduzirá 6,3% da safra – Geral – Estadão. Estadao. Available at: https://www. estadao.com.br/noticias/geral,cana-seca-reduzira- 6-3-da-safra,117410 [Accessed May 2, 2022].
Cattani D. J. y Struik P. C. (2001). Tillering, internode development, and dry matter partitioning in creeping bentgrass. Crop Sci. 41, pp. 111–118. doi:10.2135/ cropsci2001.411111x.
Cavalcanti J. (2010). Cana sob estiagem. D. Pernambuco. [Accessed May 2, 2022]. Cock J. H., Amaya A., Bohórquez C. y Munchmeyer B. (1997). Simulation of production potential of selfdefoliating sugarcane cultivars. F. Crop. Res. 54, pp. 1–8. doi:10.1016/S0378-4290(96)01019-2.
Djanaguiraman M., Perumal R., Jagadish S. V. K., Ciampitti I. A., Welti R., y Prasad, P. V. V. (2018). Sensitivity of sorghum pollen and pistil to high‐temperature stress. Plant. Cell Environ. 41, pp. 1065–1082. doi:10.1111/pce.13089.
Ebrahim M. K., Zingsheim O., El-Shourbagy M. N., Moore P. H. y Komor E. (1998). Growth and sugar storage in sugarcane grown at temperatures below and above optimum. J. Plant Physiol. 153, pp. 593–602. doi:10.1016/S0176-1617(98)80209-5.
Gardner F. P., Pearce R. B. y Mitchell R. L. (2017). Physiology of crop plants. 2nd ed. Scientific Publishers.
Gilbert R. A., Rainbolt C. R., Morris D. R. y Bennett A. C. (2007). Morphological responses of sugarcane to long‐term flooding. Agron. J. 99, pp. 1622–1628. doi:10.2134/agronj2007.0085.
Glaz B. y Lingle S. E. (2012). Flood duration and time of flood onset effects on recently planted sugarcane. Agron. J. 104, pp. 575–583. doi:10.2134/agronj2011.0351.
Gómez C., Buitrago C., Cante M. y Huertas B. (1999). Ecofisiología de papa (Solanum tuberosum) utilizada para cultivo fresco y para la industria. Rev. Comalfi 26, pp. 42–55.
Gómez L. F. y Narváez J. L. (2017). Fisiología y Ecofisiología de la caña de azucar. Cali.
Hunt R. (1978). Plant growth analysis. First. London: Edward Arnold Publishers.
____ (1990). Basic growth analysis: plant growth analysis for beginners. First. Boston: Unwin Hyman.
____ (2017). Growth analysis, individual plants, en Encyclopedia of Applied Plant Sciences (Elsevier), pp. 421–429. doi:10.1016/B978-0-12-394807- 6.00226-4.
Hunt R., Causton D. R., Shipley B. y Askew A. P. (2002). A modern tool for classical plant growth analysis. Ann. Bot. 90, pp. 485–8. doi:10.1093/aob/mcf214.
Inman-Bamber N., Muchow R. y Robertson, M. (2002). Dry matter partitioning of sugarcane in Australia and South Africa. F. Crop. Res. 76, pp. 71–84. doi:10.1016/S0378-4290(02)00044-8.
Inman-Bamber N. G., Bonnett G. D., Spillman M. F., Hewitt M. L. y Xu, J. (2009). Source – sink differences in genotypes and water regimes influencing sucrose accumulation in sugarcane stalks. Crop Pasture Sci. 60, 316 pp. doi:10.1071/CP08272.
Inman-Bamber N. G. y Smith D. M. (2005). Water relations in sugarcane and response to water deficits. F. Crop. Res. 92, pp. 185–202. doi:10.1016/j.fcr.2005.01.023.
Jane S. A., Fernandes F. A., Silva E. M., Muniz J. A., Fernandes T. J. y Pimentel G. V. (2020). Adjusting the growth curve of sugarcane varieties using nonlinear models. Ciência Rural 50. doi:10.1590/0103- 8478cr20190408.
Karno (2007). Physiology of bud outgrowth in sugarcane. Available at: https://espace.library.uq.edu.au/view/ UQ:135076 [Accessed April 23, 2022].
Larcher W. (2003). Environmental influences on growth and development, en Physiological Plant Ecology, pp. 297–343. doi:10.1007/978-3-662-05214-3_5.
Li X., Qian Q., Fu Z., Wang Y., Xiong G., Zeng D. et al. (2003). Control of tillering in rice. Nature 422, 618–621. doi:10.1038/nature01518.
Liu Y. Y., Li J., Liu S. C., Yu Q., Tong X. J., Zhu T. T. et al. (2020). Sugarcane leaf photosynthetic light responses and their difference between varieties under high temperature stress. Photosynthetica 58, pp. 1009– 1018. doi:10.32615/ps.2020.038.
Matsuoka S. y Stolf R. (2012). Sugarcane tillering and ratooning: Key factors for a profitable cropping, en Sugarcane: production, cultivation and uses, pp.137–158.
McCormick A. J., Cramer M. D. y Watt D. A. (2006). Sink strength regulates photosynthesis in sugarcane. New Phytol. 171, pp. 759–770. doi:10.1111/j.1469-8137.2006.01785.x.
McCormick A. J., Cramer M. D. y Watt D. A. (2008). Culm sucrose accumulation promotes physiological decline of mature leaves in ripening sugarcane. F. Crop. Res. 108, pp. 250–258. doi:10.1016/j. fcr.2008.06.004.
Medina S., Vicente R., Nieto-Taladriz M. T. Aparicio N., Chairi F., Vergara-Díaz O. et al. (2019). The planttranspiration response to vapor pressure deficit (VPD) in durum wheat is associated with differential yield performance and specific expression of genes involved in primary metabolism and water transport. Front. Plant Sci. 9, 1994 pp. doi:10.3389/ fpls.2018.01994. Referencias Fisiología aplicada a la producción de la caña de azúcar en Colombia 38BIOLOGÍA
Moore P. H. y Botha F. C. (2013). Sugarcane: Physiology, Biochemistry, and Functional Biology. Eds. P. H. Moore y F. C. Botha Chichester, UK: John Wiley & Sons Ltd. doi:10.1002/9781118771280.
Muchow R. C., Robertson M. J. and Wood A. W. (1996). Growth of sugarcane under high input conditions in tropical Australia. II. Sucrose accumulation and commercial yield. F. Crop. Res. 48, pp. 27–36. doi:10.1016/0378-4290(96)00042-1.
Muñoz C. A. U., y Villegas F. de J. T. (2020). Effects of meteorological variables on sugarcane ripening in the Cauca river valley, Colombia. Pesqui. Agropecuária Trop. 50, pp. 1–8. doi:10.1590/1983-40632020v5060815.
Palachai C. H., Songsri P. y Jongrungklang N. (2019). Comparison of yield components of sugarcane varieties grown under natural short- and long-term water-logged conditions in Thailand. SABRAO J. Breed. Genet. 51, pp. 80–92.
Pan J., Sharif R., Xu X. y Chen X. (2021). Mechanisms of waterlogging tolerance in plants: research progress and prospects. Front. Plant Sci. 11, 2319. doi:10.3389/fpls.2020.627331.
Prasad P. V. V., Pisipati S. R., Ristic Z., Bukovnik U. y Fritz A. K. (2008). Impact of nighttime temperature on physiology and growth of spring wheat. Crop Sci. 48, pp. 2372–2380. doi:10.2135/cropsci2007.12.0717.
Quevedo-Amaya Y. M., Beltrán-Medina J. I., Hoyos- Cartagena J. Á., Calderón-Carvajal J. E. y and Barragán-Quijano, E. (2020). Selection of sowing date and biofertilization as alternatives to improve the yield and profitability of the F68 rice variety. Agron. Colomb. 38, 61–72. doi:10.15446/agron. colomb.v38n1.79803.
Rivera-Mendes Y. D. y Romero H. M. (2017). Fitting of photosynthetic response curves to photosynthetically active radiation in oil palm. Agron. Colomb. 35, pp. 323–329. doi:10.15446/agron.colomb.v35n3.63119.
Sage R. F., Peixoto M. M. y Sage, T. L. (2013). Photosynthesis in sugarcane, en Sugarcane: Physiology, Biochemistry, and Functional Biology (John Wiley & Sons Ltd), pp. 121–154. doi:10.1002/9781118771280.ch6.
Santos, F., and Diola, V. (2015). “Physiology,” in Sugarcane (Elsevier), 13–33. doi:10.1016/B978-0-12-802239-9.00002-5.
Schwerz F., Medeiros S. L. P., Elli E. F., Eloy E., Sgarbossa J. y Caron B. O. (2018). Plant growth, radiation use efficiency and yield of sugarcane cultivated in agroforestry systems: An alternative for threatened ecosystems. An. Acad. Bras. Cienc. 90, pp. 3265–3283. doi:10.1590/0001-3765201820160806.
Schymanski S. J. y Or D. (2015). Wind effects on leaf transpiration challenge the concept of potential evaporation. Proc. Int. Assoc. Hydrol. Sci. 371, pp. 99–107. doi:10.5194/piahs-371-99-2015.
Sharma K. K. y Vadez V. (2017). Effect of vapour pressure deficit on sugarcane transpiration efficiency in a drying soil. En InterDrought-V (Hyderabad, India). Available at: http://oar.icrisat.org/10705/1/214.pdf [Accessed May 10, 2022].
Silva M. D. A., Silva J. A. G. da, Enciso J., Sharma V. y Jifon J. (2008). Yield components as indicators of drought tolerance of sugarcane. Sci. Agric. 65, pp. 620–627. doi:10.1590/S0103-90162008000600008.
Singh S., Singh S. P., Pathak A. D. y Pandey, N. (2019). Assessment of waterlogging induced physiobiochemical changes in sugarcane varieties and its association with waterlogging tolerance. J. Environ. Biol. 40, pp. 384–392. doi:10.22438/jeb/40/3/MRN-898.
Steed G., Ramírez D. C., Hannah M. A. y Webb A. A. R. (2021).Chronoculture, harnessing the circadian clock to improve crop yield and sustainability. Science (80-.), 372 pp. doi:10.1126/science.abc9141.
Sunoj V. S. J., Prasad P. V. V., Ciampitti I. A. y Maswada H. F. (2020). Narrowing diurnal temperature amplitude alters carbon tradeoff and reduces growth in C4 crop sorghum. Front. Plant Sci. 11, 1262 pp. doi:10.3389/fpls.2020.01262.
Tekalign T. y Hammes P. S. (2005). Growth and productivity of potato as influenced by cultivar and reproductive growth: II. Growth analysis, tuber yield and quality. Sci. Hortic. (Amsterdam). 105, pp. 29–44. doi:10.1016/j.scienta.2005.01.021. 39
Uehara N., Sasaki H., Aoki N. y Ohsugi R. (2009). Effects of the temperature lowered in the daytime and nighttime on sugar accumulation in sugarcane. Plant Prod. Sci. 12, pp. 420–427. doi:10.1626/pps.12.420.
Uys L., Botha F. C., Hofmeyr J.-H. S. y Rohwer J. M. (2007). Kinetic model of sucrose accumulation in maturing sugarcane culm tissue. Phytochemistry 68, pp. 2375–2392. doi:10.1016/j.phytochem.2007.04.023.
Van Heerden P. D. R., Eggleston G. y Donaldson R. A. (2013). Ripening and postharvest deterioration. En Sugarcane: Physiology, Biochemistry, and Functional Biology (Chichester, UK: John Wiley & Sons Ltd), pp. 55–84. doi:10.1002/9781118771280. ch4.
Yang M. y Jiao Y. (2016). Regulation of axillary meristem initiation by transcription factors and plant hormones. Front. Plant Sci. 7, 183 pp. doi:10.3389/ FPLS.2016.00183/BIBTEX.
Zhang Y.-B., Yang S.-L., Dao J.-M., Deng J., Shahzad A. N., Fan X. et al. (2020). Drought-induced alterations in photosynthetic, ultrastructural and biochemical traits of contrasting sugarcane genotypes. PLoS One 15, e0235845. doi:10.1371/journal.pone.0235845.
Zhou W., Chen F., Meng Y., Chandrasekaran U., Luo X., Yang W. et al. (2020). Plant waterlogging/flooding stress responses: From seed germination to maturation. Plant Physiol. Biochem. 148, pp. 228–236. doi:10.1016/j.plaphy.2020.01.020.
- Caña de azúcar. 2. Fisiología vegetal. 3. Fotosíntesis. 4. Déficit hídrico. 5. Anegamiento.
Quevedo Amaya, Y. M., Cepeda Quevedo, A. M. & López Murcia, M. A. (2023). Fisiología aplicada a la producción de la caña de azúcar en Colombia. En: Centro de investigación de la caña de azúcar de Colombia (Ed). Agroindustria de la caña de azúcar en Colombia. Cenicaña