Ómicas
Autores: Carolina Saavedra-Díaz1,2*, Jhon Henry Trujillo-Montenegro1, Alejandra Londoño1, Hugo Arley Jaimes1, John Jaime Riascos1, Fredy Antonio Salazar Villareal1, Luis Orlando López1, Carlos Arturo Viveros Valens1, Jershon Lopez1, Fernando S. Aguilar1
La caña de azúcar (Saccharum spp.) es uno de los principales cultivos agroindustriales usados para la producción de azúcar, etanol y energía en el mundo, y es un componente importante en la económica de muchos países tropicales y subtropicales. A nivel mundial, el cultivo de la caña de azúcar contribuye con aproximadamente el 26% de los biocombustibles y cerca del 80% del azúcar de mesa (ISO, 2020; Heller-Uszynska et al., 2011; OECD/FAO, 2020). El azúcar de mesa o sacarosa es un disacárido proveniente de la unión de glucosa y fructosa y constituye aproximadamente el 50% del total de materia seca del tallo maduro de la caña de azúcar. Sin embargo, la acumulación de sacarosa en los tallos de la planta puede verse afectada por diversos factores, tales como la variedad sembrada, el manejo del cultivo, la precipitación, luminosidad, oscilación de temperatura, la humedad del suelo y el tipo de suelo donde se desarrolla el cultivo (Larrahondo & Villegas, 1995). En cuanto a la humedad, Larrahondo & Villegas (1995), concluyen que es un factor importante para la síntesis y traslocación de azúcares, dado que, cuando el contenido de humedad en la planta disminuye, se produce la conversión de azucares reductores a sacarosa, impactando así la producción de este polisacárido. Por esta razón, se caracterizó la acumulación de sacarosa en una población diversa de caña de azúcar en ambientes de alta humedad.
Con el objetivo de explicar la variabilidad fenotípica de la acumulación de sacarosa (% caña), dentro de la alianza “Optimización Multiescala In-silico de Cultivos Agrícolas Sostenibles” (Ómicas) se está trabajando con una población diversa compuesta por 220 variedades, de las cuales 98 representan la diversidad genética del banco de germoplasma de CENICAÑA (Salazar et al., 2012), mientras que 122 abarcan una diversidad en términos de especies silvestres (Saccharum spp., y Erianthus spp.,), de introducciones de programas de mejoramiento genético del mundo, y de individuos tolerantes/susceptibles a plagas y enfermedades limitantes. Estas 220 variedades fueron sembradas en el ambiente húmedo del valle geográfico del río Cauca, en predios de la hacienda Taula Mejía (Ingenio La Cabaña). Esta hacienda, se encuentra ubicada dentro de la zona agroecológica 6H4, la cual se caracteriza por la presencia de suelos con alta humedad (con excesos entre 400 y 600 mm/año), con predominancia de suelos arcillosos, de texturas finas y con condiciones de poca aireación (Quintero et al, 2008; Carbonell et al, 2011). A cada una de las 220 variedades, se les midió la acumulación de sacarosa (% caña) durante las dos primeras cosechas (plantilla y primera soca). Esta medición fue realizada a los 13 meses después de la siembra (mds) por medio del método directo-cenicaña o DAC (Larrahondo y Torres, 1989). Cabe mencionar que, durante la plantilla, el promedio de sacarosa de las 220 variedades fue de 15.72%, mientras que en la primera soca este promedio decayó a 13.65%. Estas diferencias pueden estar asociados con factores ambientales como la precipitación, la cual fue de 1216 mm durante la plantilla y de 1713 mm en la primera soca, favoreciendo una mayor acumulación de sacarosa en el primer corte.
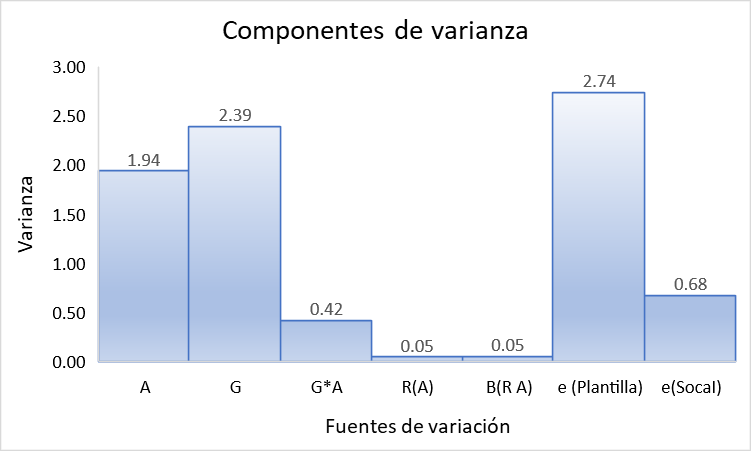
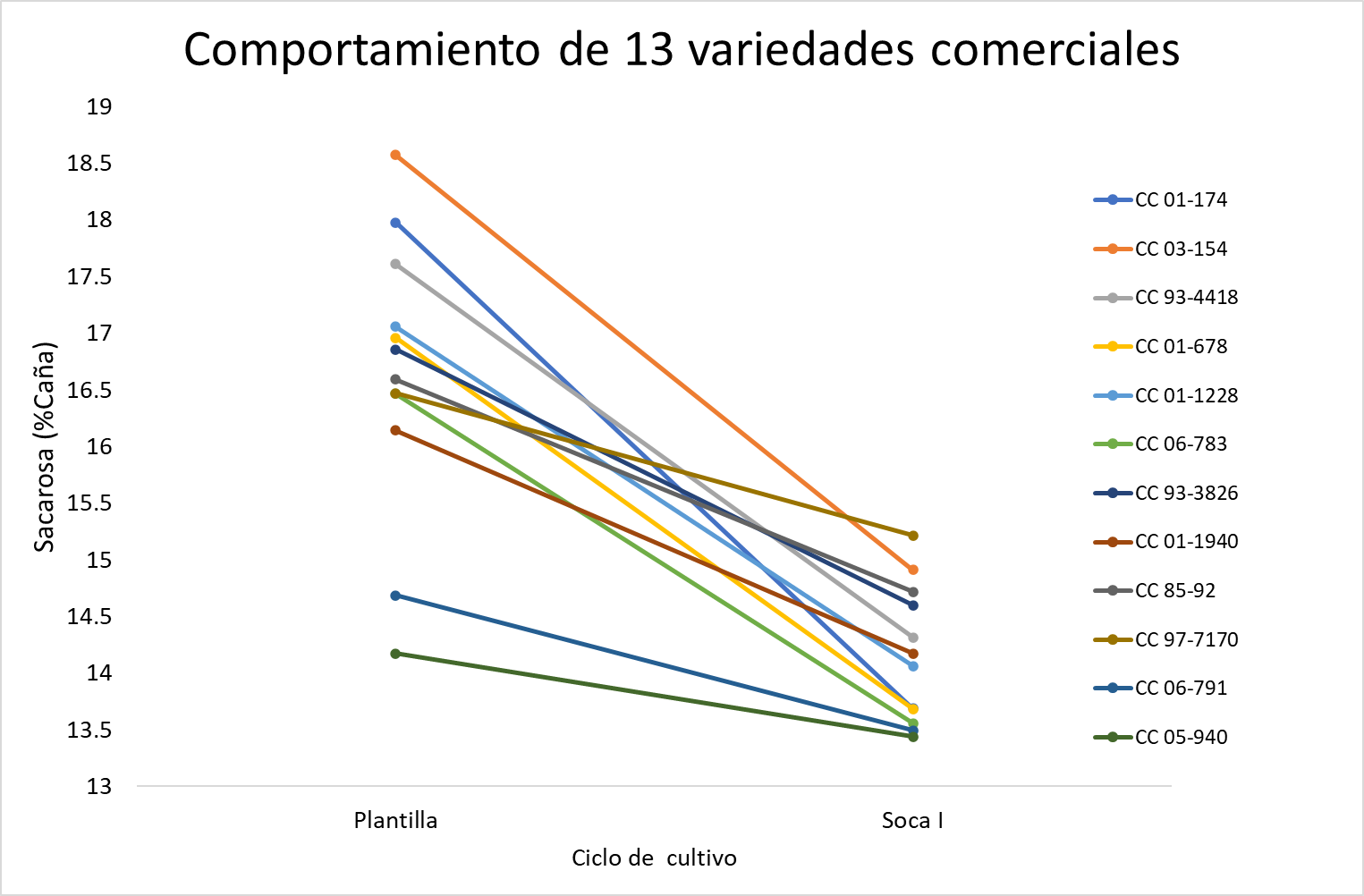
Al realizar el análisis entre variedades para la acumulación de sacarosa, se evidencia que el efecto de la variedad representa la mayor parte de la variación observada para la variable de sacarosa (% Caña), al presentar una varianza de 2.39 (Figura 1). Sin embargo, el efecto ambiental (i.e., Plantilla o Soca) presento una varianza de 1.94 (Figura 1), sugiriendo que la acumulación de sacarosa (% Caña) es también afectada por el ambiente (Figura 1). Al evaluar el patrón de acumulación de sacarosa entre cosechas para 12 variedades comerciales dentro de las 220 variedades (Figura 2) se evidencia que esta fue mayor durante la plantilla, con las variedades CC 05-940 y CC 06-791, siendo poco afectadas por las condiciones ambientales. Estas dos variedades, CC 05-940 y CC 06-791, fueron seleccionadas por el programa de mejoramiento genético de Cenicaña, como materiales adaptados a las condiciones húmedas del valle del río Cauca, y por tanto registraron la menor disminución con un 0.73 y 1.19 unidades porcentuales de sacarosa (% Caña), respectivamente, al pasar de la plantilla (con precipitación acumulada de 1216 mm) a la primera soca (con precipitación acumulada de 1713 mm) (Figura 2). Por el contrario, las variedades CC 01-174, CC 03-154, CC 93-4418 y CC 01-678, originalmente mejoradas para ambientes secos del valle del río Cauca, presentan una gran disminución en la acumulación de sacarosa al pasar de la plantilla a la soca, reduciendo más de 3.27 unidades porcentuales de sacarosa (Figura 2). Variedades como CC 85-92 y CC 01-1940 tuvieron una disminución leve, no mayor a 1.88 unidades porcentuales de sacarosa (% Caña). Este patrón de comportamiento fue registrado en otras 184 variedades, sugiriendo que la menor precipitación durante la plantilla permitió una mayor conversión de azucares reductores a sacarosa (Larrahondo y Villegas 1995).
A continuación, se realizó un análisis de agrupamiento varietal, el cual consistió en clasificar las variedades en grupos acorde con su acumulación de sacarosa. Con este análisis se obtuvieron dos grupos. El primero consistió en 205 variedades, principalmente híbridos, con valores de sacarosa (% Caña) entre 11.54 % y 15.56 %, y por tanto fue referido como el grupo de alta sacarosa. El segundo grupo estuvo compuesto por 15 variedades, incluyendo especies como S. spontaneum, S. Barberi, S officinarum, y Erianthus Spp, los cuales presentaron valores de sacarosa (% Caña) entre 7.47 % y 11.08 %, siendo por tanto el grupo de baja sacarosa. Es importante mencionar que el grupo de alta sacarosa está conformado por híbridos de caña de azúcar que han sido producidos mediante la selección dentro del proceso de mejoramiento por características como alta biomasa y/o alta sacarosa, mientras el segundo grupo, conformado principalmente por especies, aportan características agronómicas como resistencia a factores bióticos, abióticos y alta biomasa.
En conclusión, se determinaron dos grupos varietales, uno con variedades con altos valores de acumulación de sacarosa (% Caña) y otro con variedades con baja acumulación sacarosa (% Caña). Esta clasificación permite evaluar el comportamiento de las variedades en conjunto con otros datos (i.e., genotípicos) en estudios de asociación genética para la búsqueda de marcadores de interés agronómico, o en procesos de selección genómica. De igual forma, debido a la amplia variabilidad entre 7,47 a 15,56% encontrada en la acumulación de sacarosa (% Caña), y a que esta variable es controlada principalmente por los efectos genéticos (i.e., variedad a sembrar) y ambientales, es fundamental seleccionar las opciones varietales adecuadas para el ambiente y zona agroecológica de los predios, para poder maximizar la rentabilidad del cultivo y aprovechar las características únicas que cada variedad tiene para ofrecer. Así, es importante tener en cuenta que la mejor forma de tener una alta productividad es sembrar la variedad correcta en el ambiente correcto y realizar el manejo agronómico adecuado a las condiciones agroclimáticas de cada suerte.
Referencias bibliográficas
- Food and Agriculture Organization of the United Nations (2020) Chapter 9. Biofuels. OECD-FAO Agric OUTLOOK 2020-2029 196–208
- Heller-Uszynska K, Uszynski G, Huttner E, Evers M, Carlig J, Caig V, Aitken K, Jackson P, Piperidis G, Cox M, Gilmour R, D’Hont A, Butterfield M, Glaszmann JC & Kilian A. (2011). Diversity Arrays Technology effectively reveals DNA polymorphism in a large and complex genome of sugarcane. Mol Breeding 28: 37–55.
- International Sugar Organization (ISO). 2020. The Sugar Market.
- Larrahondo, J.E.; Villegas, F. Control y características de maduración. CENICAÑA. El cultivo de la caña en la zona azucarera de Colombia, Calí, 1995, 3-10.
- Larrahondo, L.E.; Torres, J.S. (1989). Evaluación y determinación del azúcar recuperable de la caña de azúcar. Cenicaña
____________________
1 Centro de Investigación de la Caña de Azúcar de Colombia, Cenicaña
2 Pontificia Universidad Javeriana, Cali
* Autores de correspondencia: csaavedra@cenicana.org; fsilvaag@cenicana.org















